IF=14.4丨源井KO细胞助力发现溶酶体自噬的关键调控机制
背景
溶酶体是细胞内负责降解和回收物质的重要细胞器,其内部维持酸性环境(pH 4.5–5.0),以激活各种溶酶体水解酶。溶酶体膜蛋白经过糖基化修饰,以保护其不受酸性环境的损害。溶酶体功能的失调与多种疾病相关,包括溶酶体贮积症、神经退行性疾病、糖尿病和癌症。溶酶体自噬是细胞清除受损溶酶体的重要过程,但其具体的调控机制尚不完全清楚。
近日,Na Yeon Park等人在Nature Communications期刊发表题为“Activation of lysophagy by a TBK1-SCFFBXO3-TMEM192-TAX1BP1 axis in response to lysosomal damage”的研究论文。研究揭示TBK1-FBXO3-TMEM192-TAX1BP1轴在溶酶体损伤后激活溶酶体自噬的关键调控机制。其中,该研究利用源井构建的FBXO3基因敲除HepG2细胞用于验证FBXO3在溶酶体自噬中的关键作用。
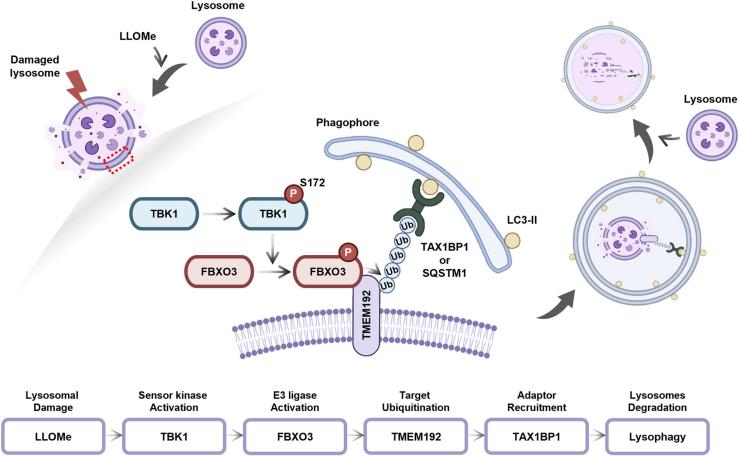
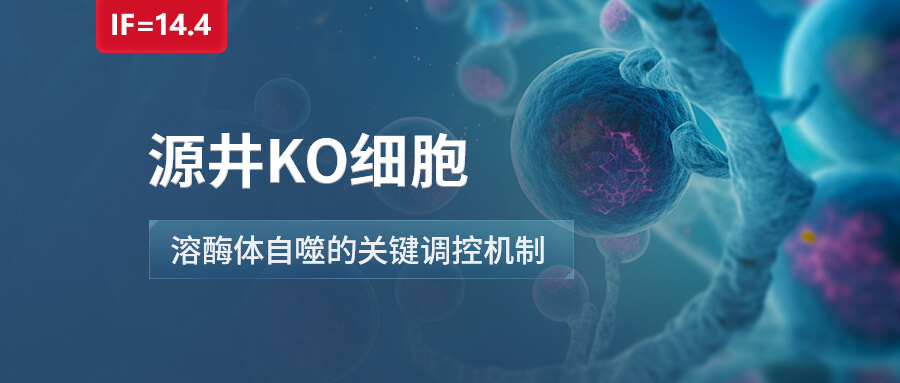
图1 TBK1-FBXO3-TMEM192-TAX1BP1 轴的溶血自噬机制示意图
筛选溶酶体自噬调节因子
研究人员开发了一种基于细胞的图像筛选系统,使用增强型绿色荧光蛋白(EGFP)标记的Gal3(EGFP-Gal3)在HepG2细胞中进行筛选。通过与溶酶体otropic剂LLOMe联合处理,结合一个泛素化化合物库进行筛选,最终确定了BC-1215作为最有效的溶酶体自噬调节剂。这一发现为后续研究提供了重要的线索。
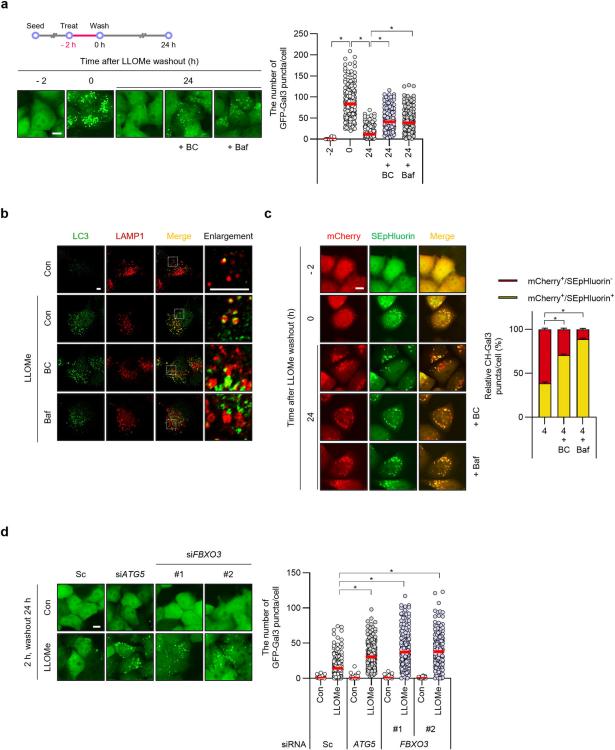
图2 抑制 FBXO3 会降低 HepG2 细胞中 Gal3 点的清除率和溶血通量
BC-1215对溶酶体自噬的影响
研究人员将HepG2/GFP-Gal3细胞与LLOMe和BC-1215共同处理,发现BC-1215显著阻碍了受损溶酶体的清除,效果类似于自噬抑制剂巴佛洛霉素A1(Baf)。此外,BC-1215单独处理对GFP-Gal3斑点的形成没有影响,表明其特异性针对LLOMe处理细胞中的溶酶体自噬。
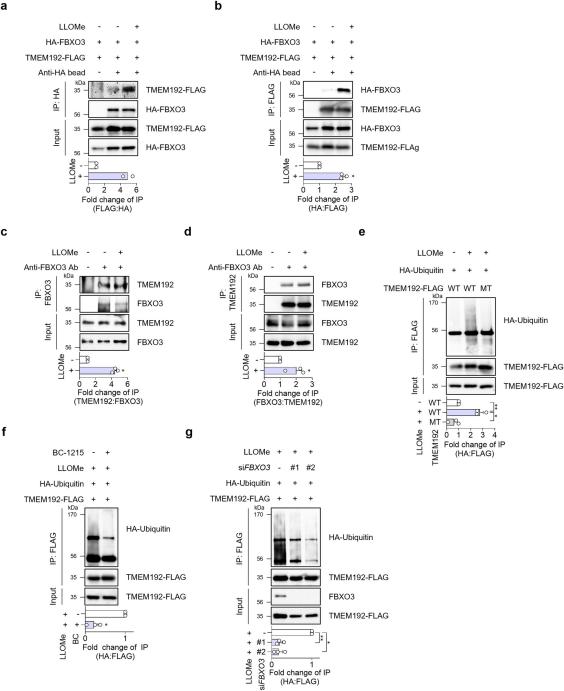
图3 FBXO3 与 TMEM192 相互作用并介导 LLOMe 处理的 HepG2 细胞中 TMEM192 的泛素化。
FBXO3在溶酶体自噬中的关键作用
通过siRNA敲低FBXO3,发现GFP-Gal3斑点的清除显著减少,与BC-1215处理的效果相似。这表明FBXO3在溶酶体自噬中起着关键作用。此外,FBXO3与溶酶体膜蛋白TMEM192的相互作用在LLOMe处理后显著增强,且FBXO3介导了TMEM192的泛素化,这一过程在溶酶体损伤后尤为重要。
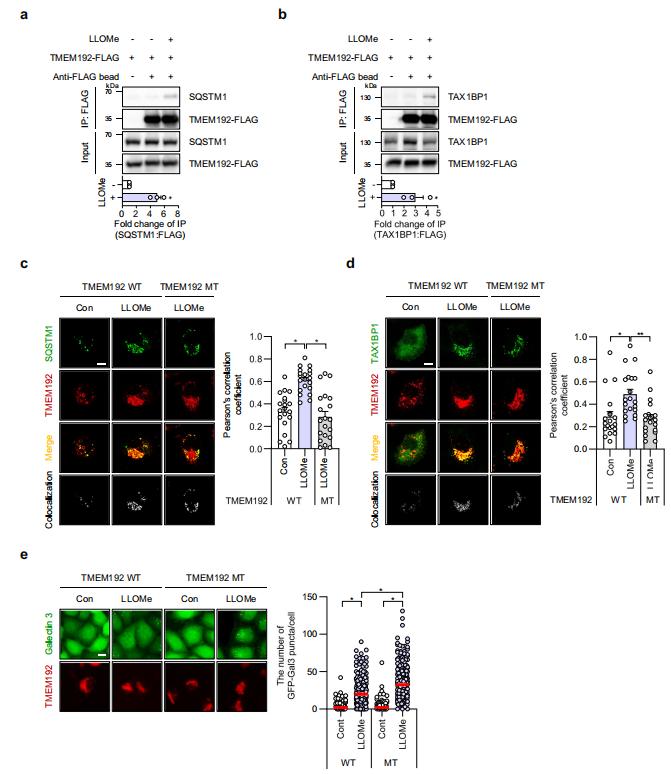
图4 TMEM192 与 SQSTM1 和 TAX1BP1 相互作用,作为响应溶酶体损伤的自噬接头蛋白。
TBK1的激活及其对FBXO3的磷酸化
研究发现TBK1在LLOMe处理后被激活,其抑制剂MRT67307和GSK8612减少了GFP-Gal3斑点的清除。这表明TBK1的激活对溶酶体自噬至关重要。通过免疫共沉淀实验,研究人员发现TBK1与FBXO3相互作用,并在溶酶体损伤后增强这种相互作用。此外,TBK1通过磷酸化FBXO3来调节其活性,这一过程在溶酶体损伤后尤为重要。
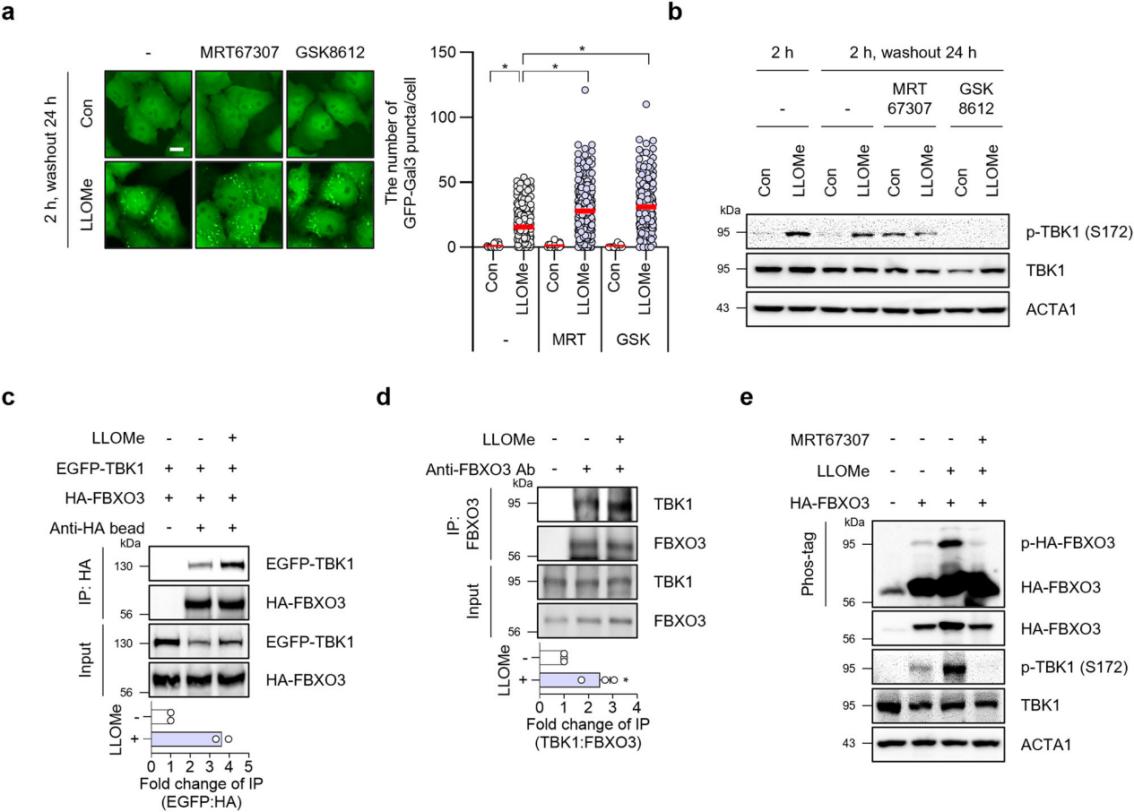
图5 TBK1 在 LLOMe 处理的 HepG2 细胞中被激活并介导 FBXO3 的磷酸化。
TMEM192的泛素化及其与自噬适配蛋白的相互作用
研究人员发现TMEM192在LLOMe处理后被泛素化,这一过程依赖于FBXO3。通过突变TMEM192的赖氨酸残基,研究人员证实了这些残基在泛素化过程中的关键作用。此外,泛素化的TMEM192促进了自噬适配蛋白SQSTM1和TAX1BP1的招募,从而促进溶酶体自噬。
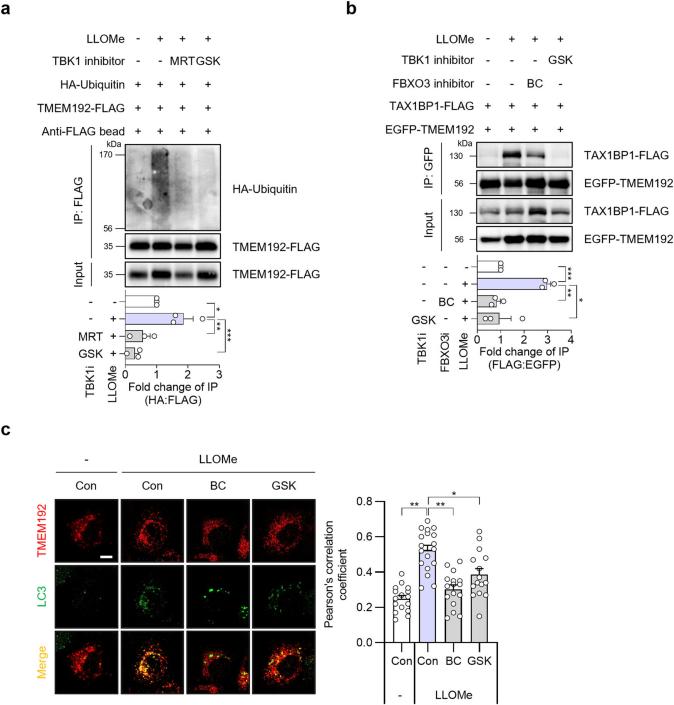
图6 TBK1-FBXO3-TMEM192-TAX1BP1 轴对 LLOMe 诱导的溶血自噬的影响。
TBK1-FBXO3-TMEM192-TAX1BP1轴在溶酶体自噬中的整体作用
综合以上发现,研究人员提出了TBK1-FBXO3-TMEM192-TAX1BP1轴在溶酶体自噬中的关键作用。TBK1的激活导致FBXO3的磷酸化,进而促进TMEM192的泛素化和TAX1BP1的招募,最终促进受损溶酶体的清除。通过使用抑制剂和基因敲除模型,研究人员进一步证实了这一轴在溶酶体自噬中的重要性。
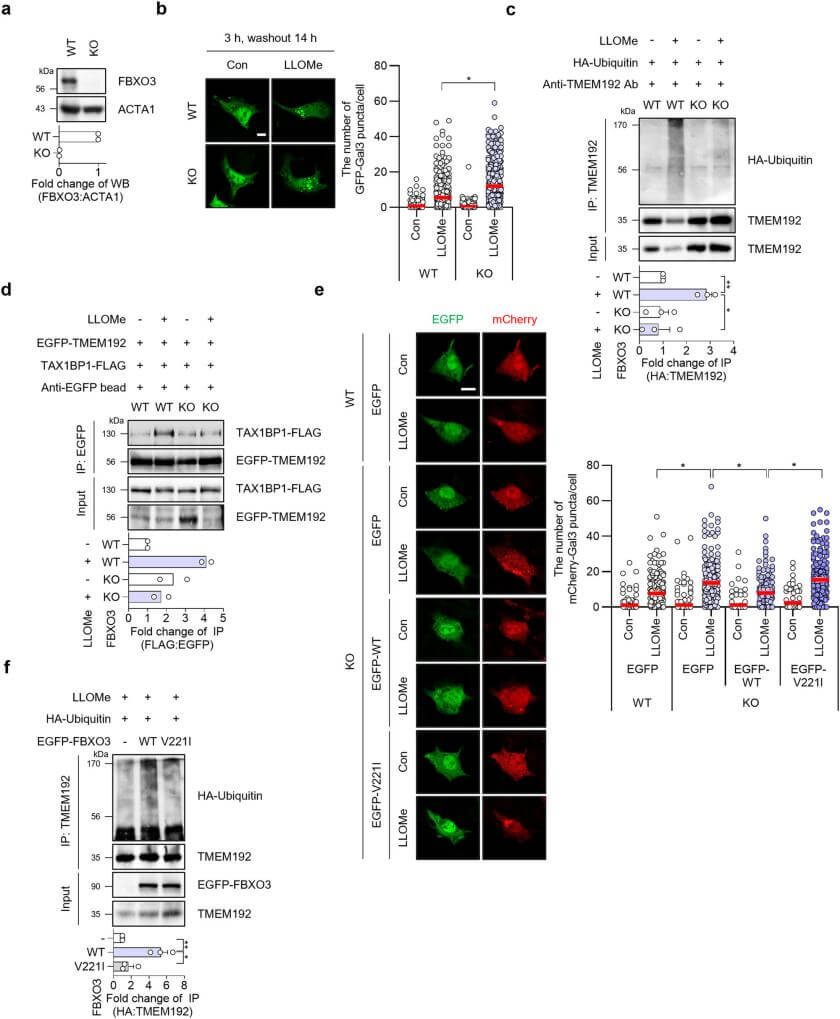
图7 FBXO3 与 FBXO3 敲除 HepG2 细胞中 LLOMe 诱导的溶血自噬的关联。
结论
- - TBK1-FBXO3-TMEM192-TAX1BP1轴是溶酶体自噬的关键调控机制,类似于线粒体自噬(mitophagy)中的PINK1-Parkin-VDAC1-SQSTM1轴。
- - FBXO3通过介导TMEM192的泛素化,促进了自噬适配蛋白的招募,从而促进了受损溶酶体的清除。
- - TBK1在溶酶体损伤后的激活是溶酶体自噬的重要上游调控机制。
更多KO细胞,欢迎咨询!
参考文献:
Park, Na Yeon, et al. "Activation of lysophagy by a TBK1-SCFFBXO3-TMEM192-TAX1BP1 axis in response to lysosomal damage." Nature Communications 16.1 (2025): 1109.
 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
 红棉 · 基因敲除计划
红棉 · 基因敲除计划

























