IF=9.1丨谷氨酰胺代谢对头颈部鳞状细胞癌放疗效果的影响

背景
头颈癌是全球第八大死因,其中约90%为头颈部鳞状细胞癌(HNSCC),其预后较差,5年总生存率仅为50%。放疗是治疗HNSCC的重要手段,但存在放疗抵抗和局部复发率高等问题。肿瘤细胞的代谢重编程使其能生长增殖并应对压力,谷氨酰胺代谢在肿瘤中起重要作用,而铁死亡是一种铁依赖的细胞死亡形式,与肿瘤治疗相关,但谷氨酰胺代谢对铁死亡的调控及其对放疗疗效的影响尚不清楚。
摘要
武汉大学团队在Cancer Letters期刊上发表了题为“Glutamine inhibition combined with CD47 blockade enhances radiotherapy-induced ferroptosis in head and neck squamous cell carcinoma”的研究论文,主要研究了头颈部鳞状细胞癌的治疗,特别是探讨了谷氨酰胺抑制和CD47阻断联合放疗对HNSCC的治疗效果。其中,该研究采用源井构建的mIrf基因敲除慢病毒,用于构建Irf-1基因敲除SCC7细胞。
放疗诱导HNSCC细胞中谷氨酰胺含量增加
放疗影响癌细胞生存和代谢,使接受放疗的细胞谷氨酰胺水平升高,葡萄糖水平降低,且放疗后细胞内谷氨酰胺水平高于未接受放疗的肿瘤细胞,血清谷氨酰胺水平在HNSCC患者中也升高,SLC1A5表达上调,其高表达与较差生存结局相关,提示谷氨酰胺代谢在HNSCC发展中起关键作用。
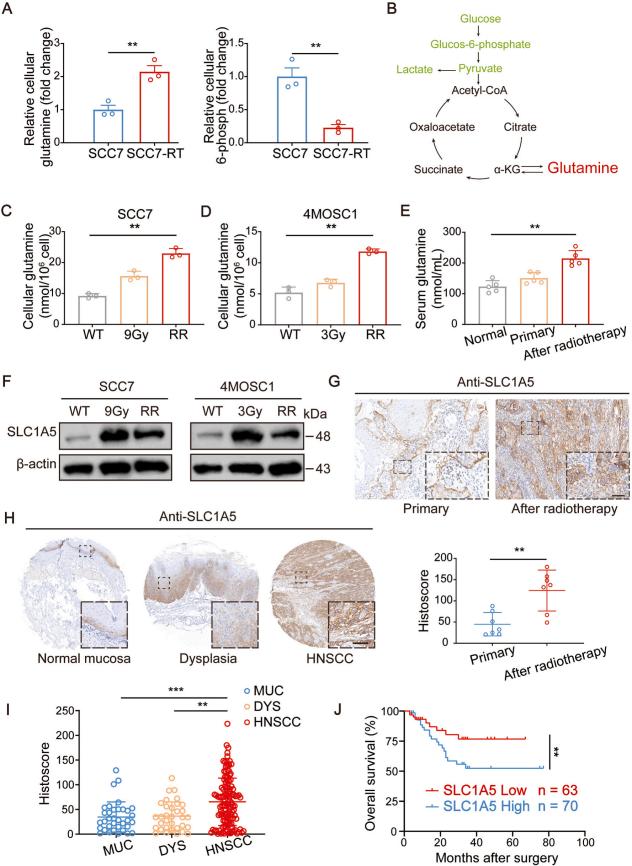
图1.放疗诱导HNSCC细胞中谷氨酰胺代谢改变
放疗联合限制谷氨酰胺摄取协同促进铁死亡
谷氨酰胺抑制剂V-9302可抑制癌细胞增殖,放疗与谷氨酰胺阻断联合处理进一步抑制细胞活性,诱导癌细胞死亡,且这种死亡主要由铁死亡介导,表现为铁离子积累、脂质过氧化增加和线粒体形态改变。

图2.放疗联合谷氨酰胺抑制诱导细胞铁死亡
协同放疗和谷氨酰胺阻断通过干扰素-γ通路增强铁死亡
放疗和谷氨酰胺阻断激活干扰素信号通路,增加干扰素释放,影响下游基因表达,其中IRF1通过调节转铁蛋白受体Tfrc参与铁死亡调控,XAF1与IRF1相互作用增强其转录活性。
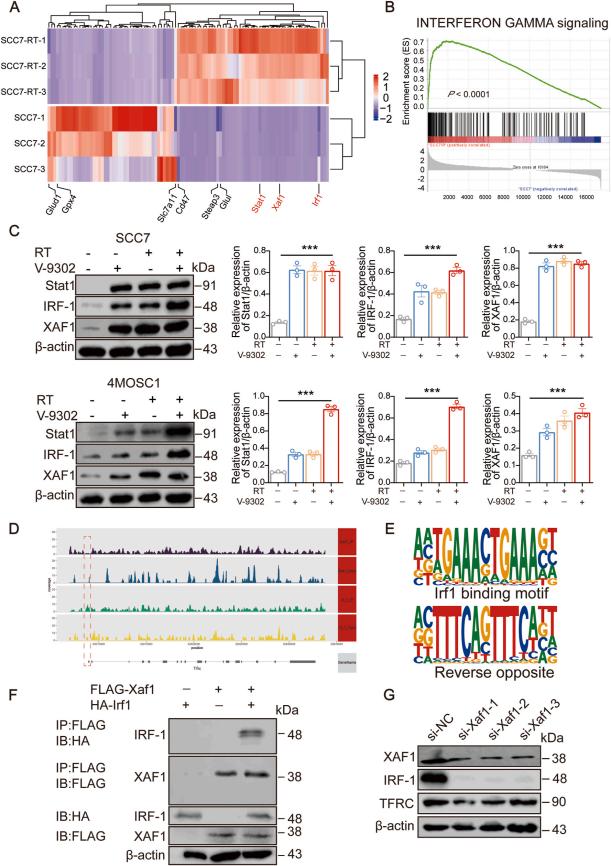
图3.协同放疗和谷氨酰胺阻断通过干扰素-γ通路诱导铁死亡
联合治疗诱导的铁死亡依赖于HNSCC中IRF1的表达
利用CRISPR/Cas9沉默IRF-1表达后,联合治疗无法诱导IRF-1敲除癌细胞发生铁死亡,体内实验也表明联合治疗对IRF-1敲除小鼠肿瘤生长无显著影响,说明放疗诱导的铁死亡依赖于IRF1表达。
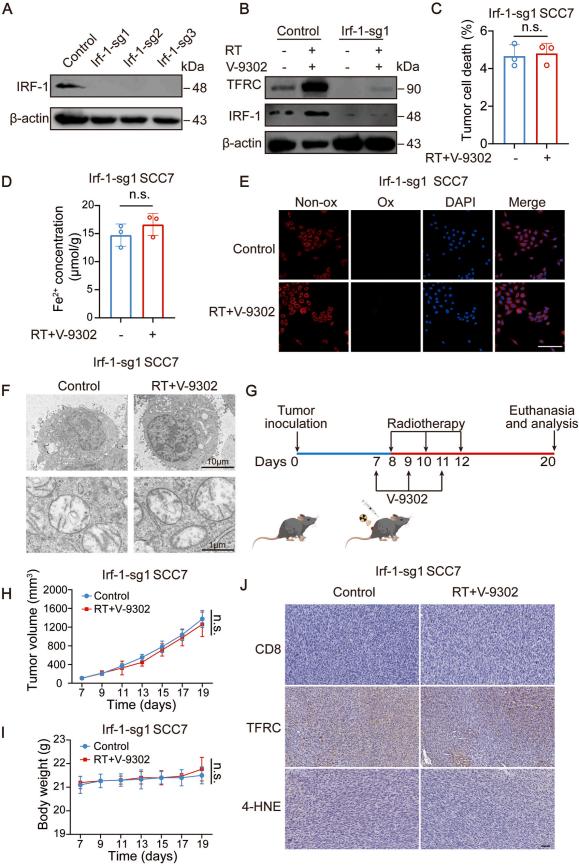
图4联合治疗诱导的铁死亡依赖于IRF1表达
放疗联合谷氨酰胺阻断削弱巨噬细胞吞噬作用
在小鼠模型中,放疗联合谷氨酰胺阻断增加了CD8+T细胞,但也增加了M2巨噬细胞比例,同时上调了肿瘤组织中CD47表达,导致巨噬细胞吞噬作用减弱,且CD47与铁死亡相关基因密切相关。
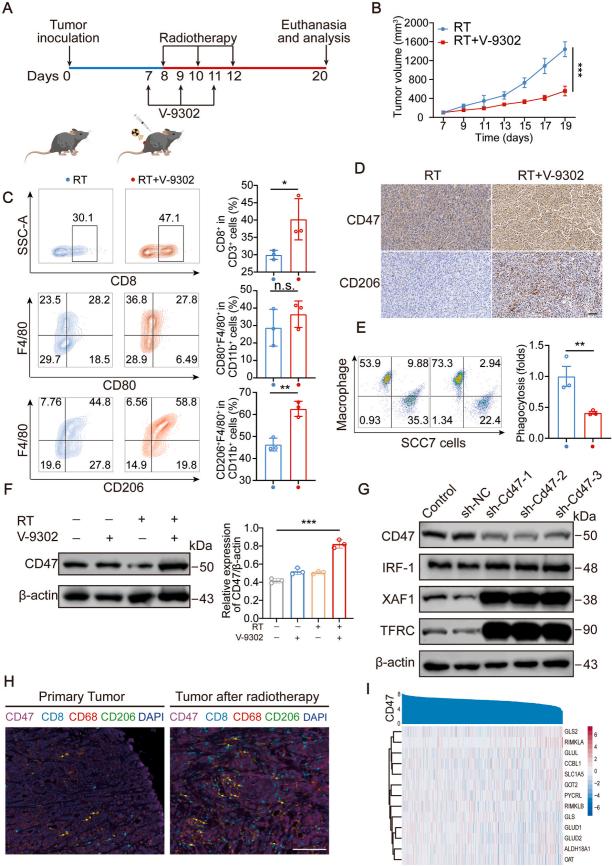
图5.谷氨酰胺抑制剂增强放疗效果
联合阻断谷氨酰胺和CD47增强了放疗对HNSCC的疗效
在小鼠模型中,联合阻断谷氨酰胺和CD47进一步增强了放疗效果,延长了小鼠生存时间,改善了肿瘤微环境,增加了肿瘤浸润CD8+T细胞数量,减少了M2巨噬细胞浸润,在多种小鼠HNSCC模型中均得到验证。
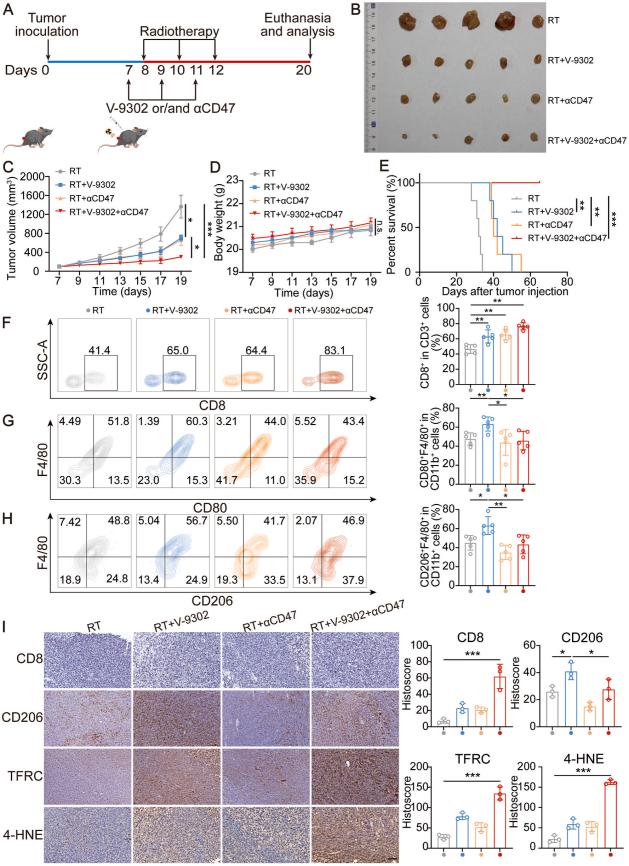
图6 三联疗法进一步增强SCC7肿瘤治疗效果
结论
该研究揭示了谷氨酰胺代谢对HNSCC放疗效果的影响,谷氨酰胺抑制联合放疗可诱导肿瘤铁死亡,但同时导致CD47介导的免疫抗吞噬作用。作者创新性地提出联合抑制谷氨酰胺摄取和CD47阻断以增强HNSCC放疗效果,改善肿瘤微环境,为提高HNSCC放疗疗效提供了新策略,强调了肿瘤通过代谢重编程实现免疫逃逸,谷氨酰胺和CD47是放疗增敏和抗吞噬的潜在靶点。
源井可提供4500+KO细胞
涵盖7大国自然热点,300+特价基因!
还可免费提供资质证明
参考文献:
Song, An et al. “Glutamine inhibition combined with CD47 blockade enhances radiotherapy-induced ferroptosis in head and neck squamous cell carcinoma.” Cancer letters vol. 588 (2024): 216727. doi:10.1016/j.canlet.2024.216727
 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
 红棉 · 基因敲除计划
红棉 · 基因敲除计划
























