一文掌握如何运用iPS敲除细胞株搭建高分研究体系,超详细讲解

诱导多能干细胞(Pluripotent Stem Cells,iPSCs)是通过特定方法将体细胞进行人工诱导,使其逆转发育状态,重新获得类似胚胎干细胞的多能性的一类干细胞,具有自我更新和多向分化能力,是目前干细胞生物学和再生医学的研究核心之一。
传统医学在面对器官衰竭、神经退行性疾病等医疗难题时,往往要依赖于异体细胞移植,但由于供体有限和异体免疫排斥反应等风险,很难取得理想的治疗效果。与此同时,由于疾病模型的缺乏,传统医疗只能以“疾病发生后的干预”为核心,难以判断致病机理和开发靶向的药物,无法实现精准治疗。而iPSCs的诞生和技术发展,为目前的医学困局带来了无限可能,其核心优势如下:
1.解决供体来源问题:iPSCs的初始来源细胞可以提取于供体的皮肤、血液以及尿液等样本,容易获取,且诱导后的iPSCs具有长期增殖的能力,能够提供足够的细胞进行下游实验或功能细胞的分化。
2.排除免疫排斥的风险:iPSCs可来源于患者自身的体细胞,能够实现患者自体细胞个性化治疗,可以完全避免异体移植所带来的免疫排斥风险。
3.规模伦理争议:细胞获取无需胚胎操作,彻底解决了伦理争议问题,符合现代科学发展的道德标准。
![iPSCs的多向分化潜能[1]](/uploads/allimg/250423/36-250423152026407.png)
图1. iPSCs的多向分化潜能[1]
iPSCs与基因编辑
CRISPR/Cas9系统因其高效、简便以及低成本等特点,已经成为目前生命科学领域中应用最为广泛的基因编辑工具。通过其关键组分sgRNA和Cas9蛋白对基因组的精准靶向切割,以及细胞修复机制的结合,CRISPR/Cas9系统能够在细胞和个体上实现精准基因编辑,包括基因敲除、碱基置换以及基因敲入等。iPSCs除了上述的核心优势之外,还具有多向分化的潜能,结合CRISPR基因编辑技术,可有效应用于疾病机理探索、药物开发以及再生医学等研究方向。
基因敲除是目前最常用的基因编辑方式,而iPSC基因敲除细胞株作为目前再生医学领域的核心研究利器之一,在近几年来一直是高分、高质量论文的“常客”。但是,有了iPSC基因敲除细胞株之后,应该如何应用呢?怎么样来搭建我们的研究体系,需要什么样的研究思路,才能在现今极度内卷的科研圈中突围而出呢?本次栏目由小源给大家带来了一些iPS敲除细胞株的“高端”用法,分析如何运用iPS敲除细胞株来提升我们研究体系的高度,发表高分文章。
iPSC敲除细胞株的应用方向
1.胚胎发育机制研究
iPSCs具有多向分化潜能,可以在特定因子的驱动下分化为不同谱系的成体细胞。因此,人源iPSCs能够很好地模拟人体早期胚胎发育过程,已被广泛用于研究组织、器官再生与修复,以及早期细胞命运决定的分子机制,是目前研究人体发育最好的体外细胞模型之一。
代表性文章:Epitranscriptomic regulation of cortical neurogenesis via Mettl8-dependent mitochondrial tRNA m3C modification,Cell Stem Cell,IF=19.8
在该研究中,美国宾夕法尼亚大学明国莉教授和宋洪军教授的研究团队利用小鼠模型和人iPSC衍生的前脑类器官模型,成功揭示了线粒体tRNA 的m3C修饰及其甲基化转移酶METTL8在调节神经发生中的重要功能,解锁了大脑皮层发育的表观转录调控新机制。在这篇文章中,作者基于在研究前期从Mettl8敲除的大脑条件性敲除小鼠中获取的线索,进一步在人iPSCs中构建了METTL8敲除细胞系,并同时将野生型和iPS敲除细胞株分化为人前脑类器官。在此过程中,作者发现了与小鼠模型基本一致的表型,METTL8缺失所引起的线粒体tRNAThr/Ser(UCN)的m3C修饰水平下调同样也会导致人前脑类器官中神经干细胞的线粒体蛋白翻译受到严重阻滞,并造成前脑类器官中神经干细胞的枯竭。RNA化学修饰已经被证明在许多重要的生物学过程和病理进程中发挥着关键作用,但这些研究目前仍然集中于m6A等热门修饰上,而其他类型修饰的功能和作用机制尚有待揭示。作者在该研究中,通过小鼠模型、iPSC敲除细胞株和人前脑类器官分化的结合,充分阐明了METTL8及其介导的mt-RNA的m3C修饰在神经干细胞线粒体蛋白翻译以及大脑皮层发育过程中的特异性调控作用,最终该成果发表于干细胞生物学顶刊《Cell Stem Cell》上[2]。
![=iPSC敲除细胞系揭示大脑皮层发育表观转录新机制[2]](/uploads/allimg/250423/36-25042315232KQ.png)
图2. iPSC敲除细胞系揭示大脑皮层发育表观转录新机制[2]
2.疾病机理探索和药物开发
一般来说,iPSC在疾病模型构建的优势在于我们能够直接从患者身上获取体细胞,并将其重编程为可以无限增殖且具有患者相同遗传背景的iPSCs。然而,对于一些存在显著个体遗传异质性,对大量不同患者体细胞的重编程无疑会加重我们实验和时间成本的负担,操作也十分繁琐,因此我们也可以在正常人来源的iPSCs中通过基因敲除、点突变或者基因敲入等方法对细胞进行基因干预或者致病突变的引入,获取相应的病理表型,构建疾病模型。
代表性文章:Commander complex regulates lysosomal function and is implicated in Parkinson’s disease risk,Science,IF=44.8
GBA1基因的杂合致病性变异是帕金森病(PD)和路易体痴呆发生的常见风险因素,而在部分患者中,溶酶体稳态异常可能与发病机制或病情发展有密切联系。在该研究中,为了找出有哪些特定基因和细胞通路能够影响GCase活性和溶酶体稳态,来自西北大学的Dimitri Krainc团队进行了全基因组CRISPR干扰筛选,以鉴定GCase活性和溶酶体功能的遗传修饰因子。基于筛选结果,他们发现铜代谢MURR1结构域蛋白3(COMMD3)及其所属的COMMD/CCDC22/CCDC93(CCC)和Commander复合体是GCase活性和溶酶体功能的潜在调节因子。在后续的功能验证中,作者在iPSCs中敲除COMMD3,并将其分化为多巴胺能神经元,COMMD3敲除会导致GCase活性下降及α-突触核蛋白聚集,能够模拟PD关键表型,并以此作为疾病模型对人体系上COMMD3的作用机制进行了深入探讨。这篇文章成功揭示了Commander复合体在溶酶体功能中的核心作用及其作为PD风险因子的作用机制,为神经退行性疾病的治疗提供了新方向,最终该文成功发表于学术顶刊《Science》上[3]。
![iPSC敲除细胞系的多巴胺神经元分化模拟PD表型[3]](/uploads/allimg/250423/36-250423152623P3.png)
图3. iPSC敲除细胞系的多巴胺神经元分化模拟PD表型[3]
3.功能细胞的工程化改造
iPSCs的多谱系分化能力让它们有潜力分化成为特定的功能性细胞,如胰岛β细胞、多巴胺神经元、免疫细胞等,可用于功能性分泌蛋白的生产和肿瘤免疫治疗。然而,这些iPSC衍生的功能细胞在使用中往往会遇到一定的挑战,如iPSC衍生的自然杀伤(iPSC-derived natural killer,iNK)细胞,在复发性、难治性急性髓系白血病的治疗中很难获得较好的疗效,得到完全缓解的患者数量很少,因此需要额外的工程化改造来提高这些iNK细胞的功效,而最常用的方法就是基因干预,如基因敲除。
代表性文章:Harnessing features of adaptive NK cells to generate iPSC-derived NK cells for enhanced immunotherapy,Cell Stem Cell,IF=19.8
在该研究中,来自美国明尼苏达大学医学系的Frank Cichocki团队和Jeffrey S. Miller团队开发了一种通过基因编辑进行工程化改造的iNK细胞产品,这种改造后的iNK即使在没有外源性细胞因子的情况下也能在体内持续存在并发挥作用,并且可以与治疗性抗体结合以增强肿瘤靶向性。基于以往研究中建立的hnCD16-iPS细胞系,作者进一步在该细胞系中敲除CD38,以获得高水平的NAD+以及更高的抗氧化应激能力,同时也能避免由治疗性抗CD38抗体达雷木单抗所介导的NK细胞自残现象。通过质谱分析的评估,CD38的敲除主要影响了糖酵解和半胱氨酸代谢,并引起细胞内半胱氨酸-谷胱甘肽二硫化物 (L-CySSG) 的水平升高,使这些细胞对氧化应激的抵抗力得到增强。此外,作者在此基础上,进一步转入IL-15/IL-15R融合蛋白,以提高细胞的功能和信号的持久性。最终,作者将这种具有显著疗效的工程化细胞命名为“iADAPT”NK,而论文成果也成功发表于干细胞生物学顶刊《Cell Stem Cell》上[4]。
![基因敲除等编辑方式对NK细胞进行工程化改造[4]](/uploads/allimg/250423/36-25042315313W60.png)
图4. 基因敲除等编辑方式对NK细胞进行工程化改造[4]
4.细胞个性化治疗
患者来源的iPSCs携带与患者本身相同的遗传背景,结合体外分化能够完美复刻疾病真实的生理学特性。根据不同疾病病理机制的不同,我们能够通过基因编辑的方法,对患者来源的iPSCs进行基因敲除或者基因修复,使其恢复正常的生理学功能,成为有潜力对患者进行个性化移植治疗的细胞来源。
代表性文章:
- CCR5 disruption in induced pluripotent stem cells using CRISPR/Cas9 provides selective resistance of immune cells to CCR5-tropic HIV-1 virus,Molecular Therapy-Nucleic Acids,IF=6.5
- CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia,The new england journal of medicine,IF=96.3
趋化因子受体5(CCR5)作为HIV病毒的共同受体,对于CCR5嗜性病毒的细胞感染至关重要,研究表明,CCR5功能性丧失可防止HIV感染。2015年,Igor I Slukvin研究团队在《Molecular Therapy-Nucleic Acids》上的工作通过基因敲除的方式获得CCR5敲除纯合子iPSC克隆[5]。这种细胞系能够有效分化为造血细胞,巨噬细胞,并在体外HIV感染实验显示出对CCR5嗜性病毒的攻击的独特抗性。基于以上研究基础以及CCR5-Δ32缺陷基因型近年来在抗HIV病毒上的显著潜力,北京大学邓宏魁、解放军总医院第五医学中心陈虎,以及首都医科大学附属北京佑安医院吴昊团队联合,在一项临床试验中,在人成体造血干细胞上进行 CCR5 基因敲除,这些敲除的干细胞在人体内实现了长期稳定的造血系统重建,并对一名患有艾滋病和急性淋巴细胞白血病的27岁男性进行治疗。经过治疗后,病人的急性淋巴白血病在形态上得到完全缓解,病人的 T 细胞对 HIV 病毒也表现出一定的抵抗能力。这项具有重要参考价值的临床研究工作最终发表于医学顶刊《The new england journal of medicine》上[6]。
![CCR5敲除iPS细胞系的构建(左);CCR5敲除干细胞移植后的疗效表现(右)[6]。](/uploads/allimg/250423/36-250423153233536.png)
图5. CCR5敲除iPS细胞系的构建(左);CCR5敲除干细胞移植后的疗效表现(右)[6]。
以上iPS敲除细胞系在高分文章中的应用解析,是否已经让各位对iPSC相关课题的设计有了灵感,开始摩拳擦掌了呢?然而,尽管iPSC应用潜力巨大,但相比于其他常用的肿瘤细胞系,iPSCs在基因编辑上还是存在较大的门槛,想要获得成功编辑的细胞系并不简单。
iPSC在基因敲除上的主要挑战
1.多能性和细胞状态难以维持:iPSCs比较“娇贵”,对培养条件要求十分苛刻,需要完善的培养体系才能较好地维持iPSC的多能性和自我更新能力。状态变差或者出现分化的现象均会严重影响iPSC的编辑效率和长期维持,而基因编辑过程中可能出现的物理刺激、外部剪切力等都有可能导致iPSC的状态变差或出现分化,严重影响iPSC的编辑效率和长期培养;
2.转染效率偏低:iPSCs转染难度较高,目前广泛应用的化学转染方法如Lipo3000、PEI等等,在人多能干细胞中转染效果都比较差,很难实现较高的转染效率。对iPSCs的转染比较依赖于电转(电穿孔),但需要对其电转条件和转染密度等一系列参数进行精准的摸索;
3.单克隆形成困难:iPSC在单克隆培养上仍然有存活低和多能性难以维持等问题,目前的单克隆获取方法普遍依赖于脱离超净工作台的克隆挑取技术,存在较大的污染风险。
基因敲除iPS细胞系的构建
目前最常用的基因敲除方式是由非同源末端连接(Non-homologous end joining,NHEJ)这种DNA双链断裂的修复方式所介导的,CRISPR/Cas9系统通过sgRNA和Cas9的作用造成基因组DNA双链断裂后,细胞体内会启动双链断裂的修复程序。其中,NHEJ修复在该过程中占比最高。该机制不要任何模板的参与,能够在特定修复蛋白和DNA连接酶的辅助下,将断裂的两段彼此拉进并接合,同时在接合处会带入随机碱基的插入或缺失。这种碱基的插入或缺失往往会造成基因的移码突变,从而导致其正常编码蛋白的缺失,实现基因敲除的效果。
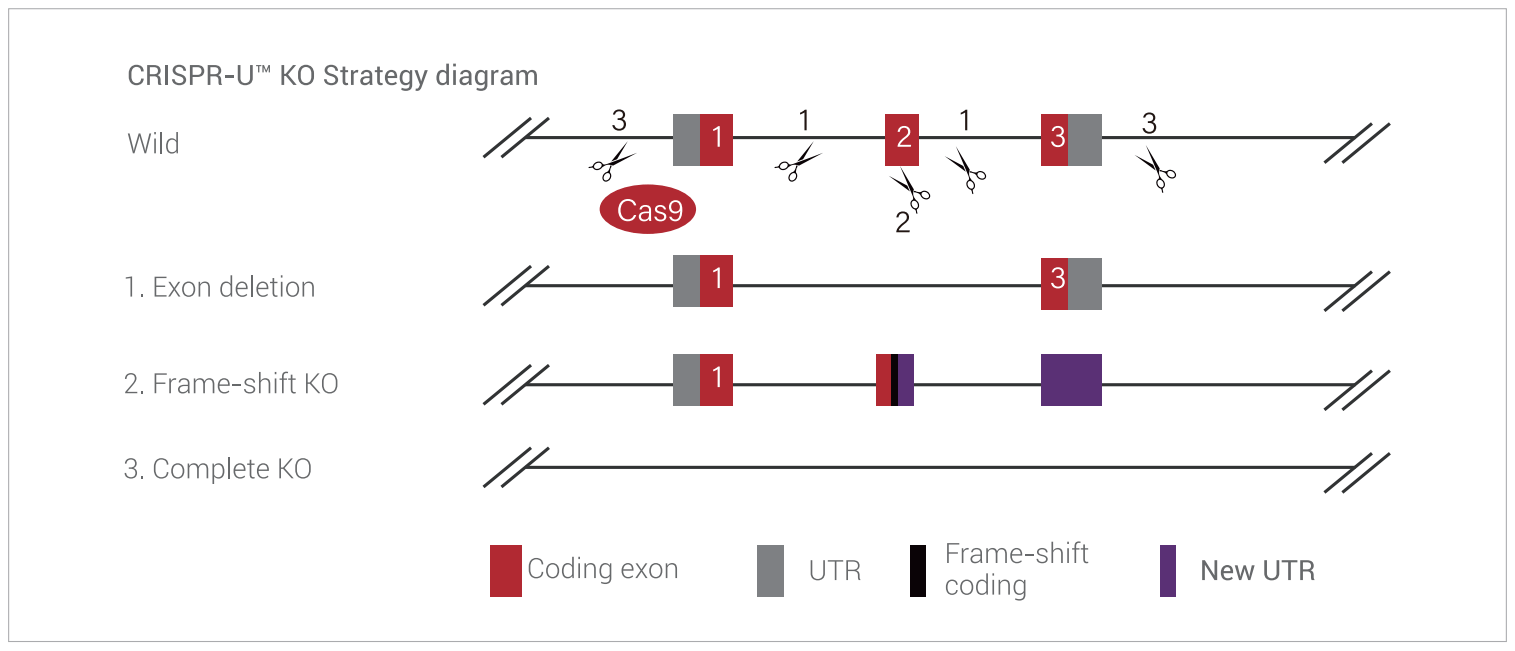
图6. 基于NHEJ机制的iPS敲除细胞系构建原理
源井生物CRISPR-U™技术基于CRISPR系统和NHEJ修复机制,结合各流程节点的优化和质控,最大化对应基因在iPSCs中的编辑效率,将iPSCs的基因编辑效率提升10-20倍,其构建流程如下:
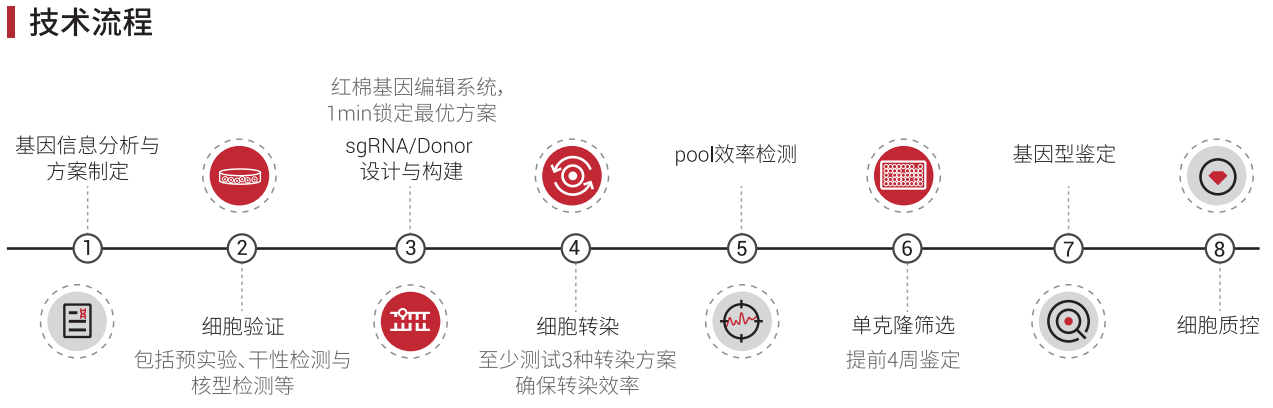
图7. iPS基因敲除细胞系构建流程
CRISPR-U™技术在iPSC基因敲除上的核心优势
源井生物基于自主研发的人多能干细胞培养体系和CRISPR-UTM技术平台,能够有效应对iPSC细胞的多能性维持、转染效率以及单克隆获取等技术难题。
1.自主研发的人多能干细胞培养体系
经过自主研发,源井生物充分优化人多能干细胞培养条件,已成功建立稳定成熟的EZ-StemTM人多能干细胞培养体系.该培养体系可大幅度提高在整个编辑周期内人iPSC的存活率、多能性维持能力以及单克隆形成率,目前也成功建立人多能干细胞库(hESCs和hiPSCs),并具有极其丰富的干细胞编辑经验。
2.红棉自动化编辑方案设计系统
源井生物自主开发的红棉基因编辑系统,全面覆盖基因编辑方案的自动化设计、基因表达量和致死性查询,以及基因型分析等基因编辑辅助功能,尽可能排除方案设计的误差和主观性,并稳定保证基因编辑的成功率和效率控制。
3.高效率阳性单克隆的获取
在前期大量的研发经验以及EZ-StemTM人多能干细胞培养体系的支撑下,源井生物已成功实现了通过极限稀释的方法对人多能干细胞进行单克隆传代和分离,在大幅改善iPSC单克隆存活率和纯度的同时,也避免了挑克隆操作可能导致的细菌污染和交叉污染问题。此外,我们也开发了快速单克隆鉴定体系,能够通过免抽提的方法在较早的时间节点对基因型进行鉴定,从而避免了对我们编辑后的人胚胎干细胞进行过多的传代操作和过长时间的培养;
4.全面的干性检测手段
源井生物的干性鉴定体系可全面覆盖人多能干细胞多能性与多向分化能力的检测,严格控制基因编辑前后iPSC的干性和质量。另外,多重复组并行的基因编辑方案也可精准锁定基因敲除后的表型体现。

iPS敲除细胞系的获取是一件耗时又费力的工程,对于iPSC的培养也大耗心神和精力,相信各位有经验的小伙伴们都深有体会。如果精力有限或者对iPSC基因编辑没有信心,源井生物能为你提供iPS细胞敲除/敲入/点突变定制服务,丰富的iPS细胞基因编辑经验确保高质量iPSC基因编辑细胞株的交付。EZ-StemTM培养体系轻松驾驭iPSC细胞培养,CRISPR-UTM技术平台护航iPSC基因编辑全流程,点击咨询了解服务详情。
相关文献
[1]akahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 2006 Aug 25.
[2]Zhang F, Yoon K, Zhang DY, Kim NS, Ming GL, Song H. Epitranscriptomic regulation of cortical neurogenesis via Mettl8-dependent mitochondrial tRNA m3C modification. Cell Stem Cell. 2023 Mar 2;30(3):300-311.e11.
[3]Minakaki G, Safren N, Bustos BI, Lubbe SJ, Mencacci NE, Krainc D. Commander complex regulates lysosomal function and is implicated in Parkinson's disease risk. Science. 2025 Apr 11;388(6743):204-211.
[4]Woan KV, Kim H, Bjordahl R, Davis ZB, Gaidarova S, Goulding J, Hancock B, Mahmood S, Abujarour R, Wang H, Tuininga K, Zhang B, Wu CY, Kodal B, Khaw M, Bendzick L, Rogers P, Ge MQ, Bonello G, Meza M, Felices M, Huffman J, Dailey T, Lee TT, Walcheck B, Malmberg KJ, Blazar BR, Bryceson YT, Valamehr B, Miller JS, Cichocki F. Harnessing features of adaptive NK cells to generate iPSC-derived NK cells for enhanced immunotherapy. Cell Stem Cell. 2021 Dec 2;28(12):2062-2075.e5.
[5]Kang H, Minder P, Park MA, Mesquitta WT, Torbett BE, Slukvin II. CCR5 Disruption in Induced Pluripotent Stem Cells Using CRISPR/Cas9 Provides Selective Resistance of Immune Cells to CCR5-tropic HIV-1 Virus. Mol Ther Nucleic Acids. 2015 Dec 15;4:e268.
[6]Xu L, Wang J, Liu Y, Xie L, Su B, Mou D, Wang L, Liu T, Wang X, Zhang B, Zhao L, Hu L, Ning H, Zhang Y, Deng K, Liu L, Lu X, Zhang T, Xu J, Li C, Wu H, Deng H, Chen H. CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia. N Engl J Med. 2019 Sep 26;381(13):1240-1247.
 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
 红棉 · 基因敲除计划
红棉 · 基因敲除计划






![iPSCs的多向分化潜能[1]](/uploads/allimg/250423/36-250423152026407.png)
![=iPSC敲除细胞系揭示大脑皮层发育表观转录新机制[2]](/uploads/allimg/250423/36-25042315232KQ.png)
![iPSC敲除细胞系的多巴胺神经元分化模拟PD表型[3]](/uploads/allimg/250423/36-250423152623P3.png)
![基因敲除等编辑方式对NK细胞进行工程化改造[4]](/uploads/allimg/250423/36-25042315313W60.png)
![CCR5敲除iPS细胞系的构建(左);CCR5敲除干细胞移植后的疗效表现(右)[6]。](/uploads/allimg/250423/36-250423153233536.png)





















