CRISPR文库锁定自噬相关基因,找出肝癌耐药“元凶”

引言
自噬(Autophagy)是细胞内的“自我清理”过程,能够降解受损的细胞器和蛋白质,维持细胞健康。近年来,自噬在癌症中的作用备受关注,尤其是在肿瘤耐药性方面。最近,一项发表在Autophagy上题为“Genome-Scale CRISPR screen identifies LAPTM5 driving lenvatinib resistance in hepatocellular carcinoma”的研究论文,利用CRISPR文库技术,在肝癌细胞中进行了全基因组筛选,发现了一个与自噬相关的关键基因——LAPTM5,随后利用HCC细胞系、患者来源的原代细胞系以及人HCC异种移植物和免疫功能正常的小鼠HCC模型,验证了LAPTM5通过调控自噬过程介导了肝癌对乐伐替尼(Lenvatinib)的耐药性。
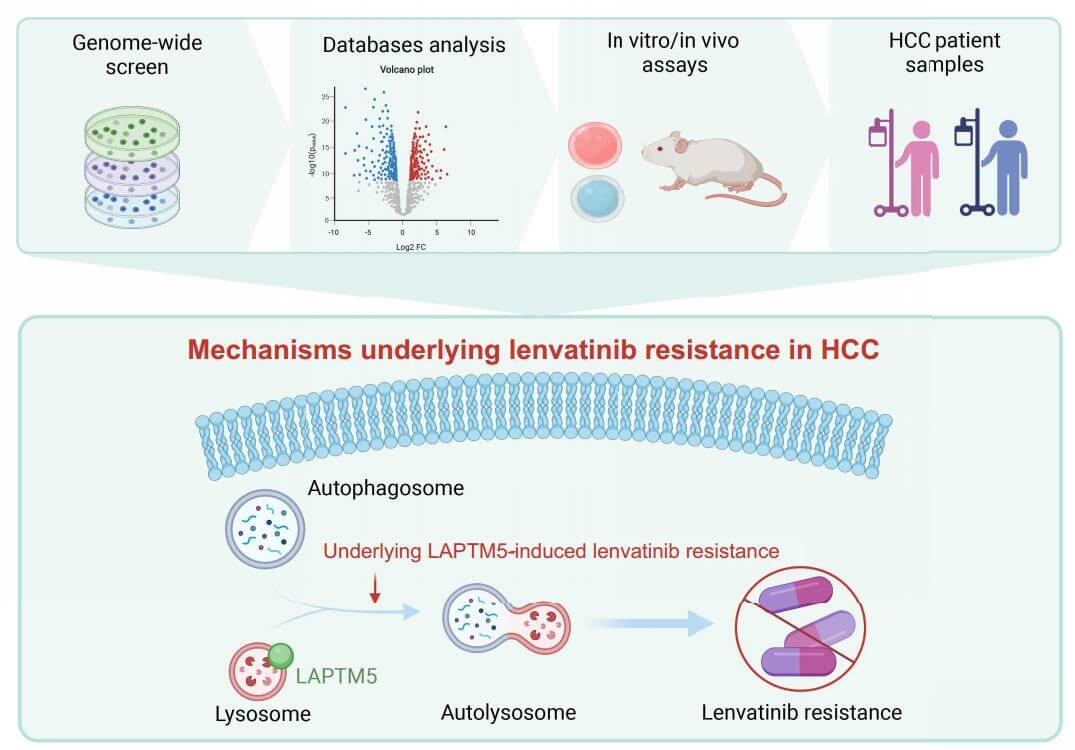
图文摘要
今天,我们就从自噬研究的角度,解读这项研究,看看CRISPR文库如何帮助科学家发现耐药机制的关键因素!
研究者们利用CRISPR-Cas9文库筛选技术,对肝癌细胞进行了全基因组范围的基因敲除筛选,目的是找到哪些基因的缺失会影响细胞对乐伐替尼的敏感性。综合全基因组筛选与数据库分析确定LAPTM5和TNXB 是HCC中乐伐替尼耐药的潜在因素。

整合全基因组CRISPR-Cas9筛查和数据库分析,揭示乐伐替尼耐药性的关键因素
为了验证TNXB和LAPTM5对耐药性的影响,通过分析TCGA和GTEx数据库比较它们在HCC组织和正常肝组织之间的表达水平,构建si-敲低细胞、sh-干扰稳转株、过表达稳转株进行体外耐药性相关研究,结果显示,LAPTM5基因的敲除显著增强了肝癌细胞对乐伐替尼的敏感性,而它的过表达则让细胞变得耐药。
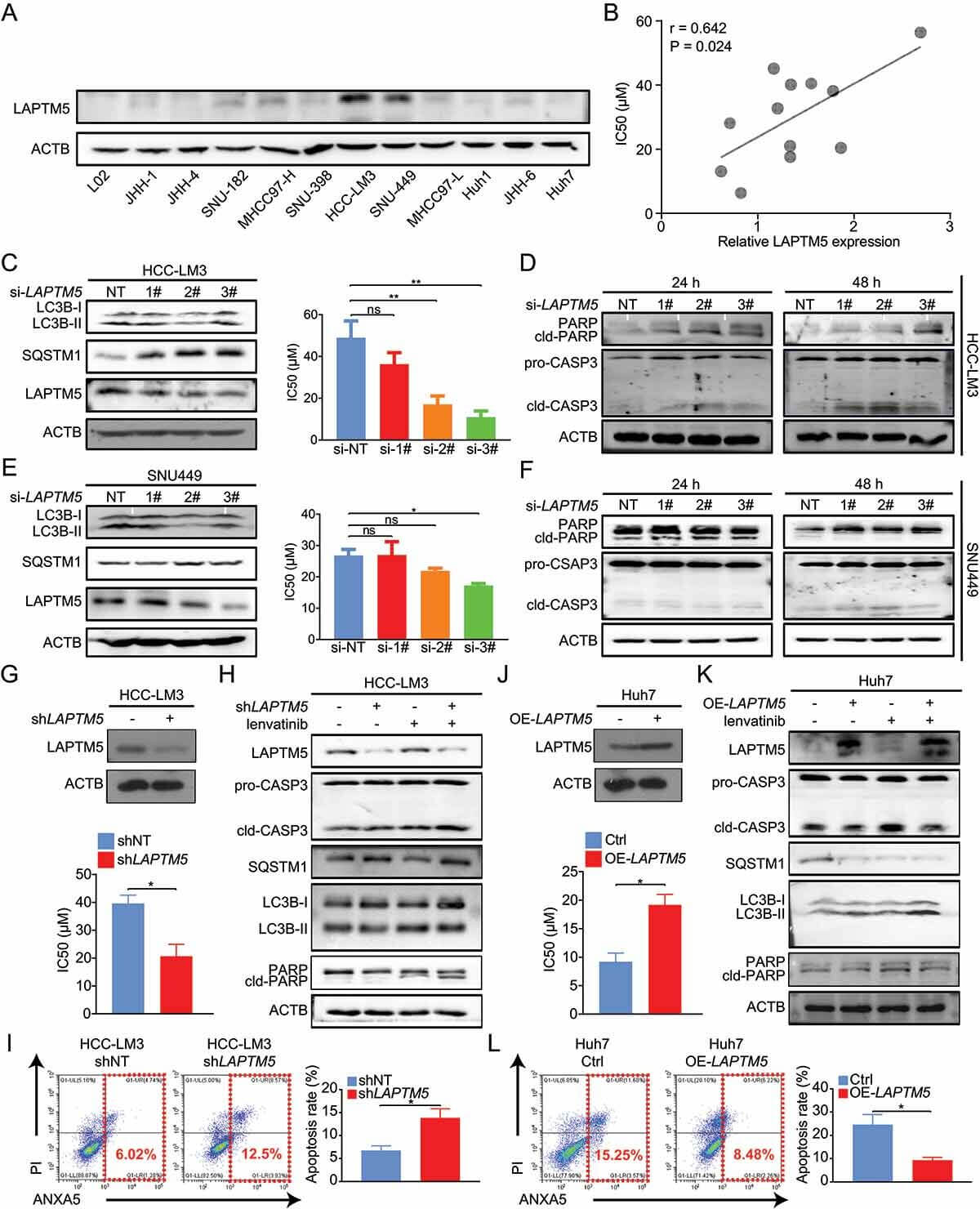
LAPTM5有助于HCC的体外lenvatinib耐药性
接着研究人员通过小鼠体内实验对LAPTM5与HCC对乐伐替尼的敏感性进行了探究,结果与细胞体外实验一致。体外与体内实验表明LAPTM5在驱动HCC中lenvatinib耐药性起关键作用。
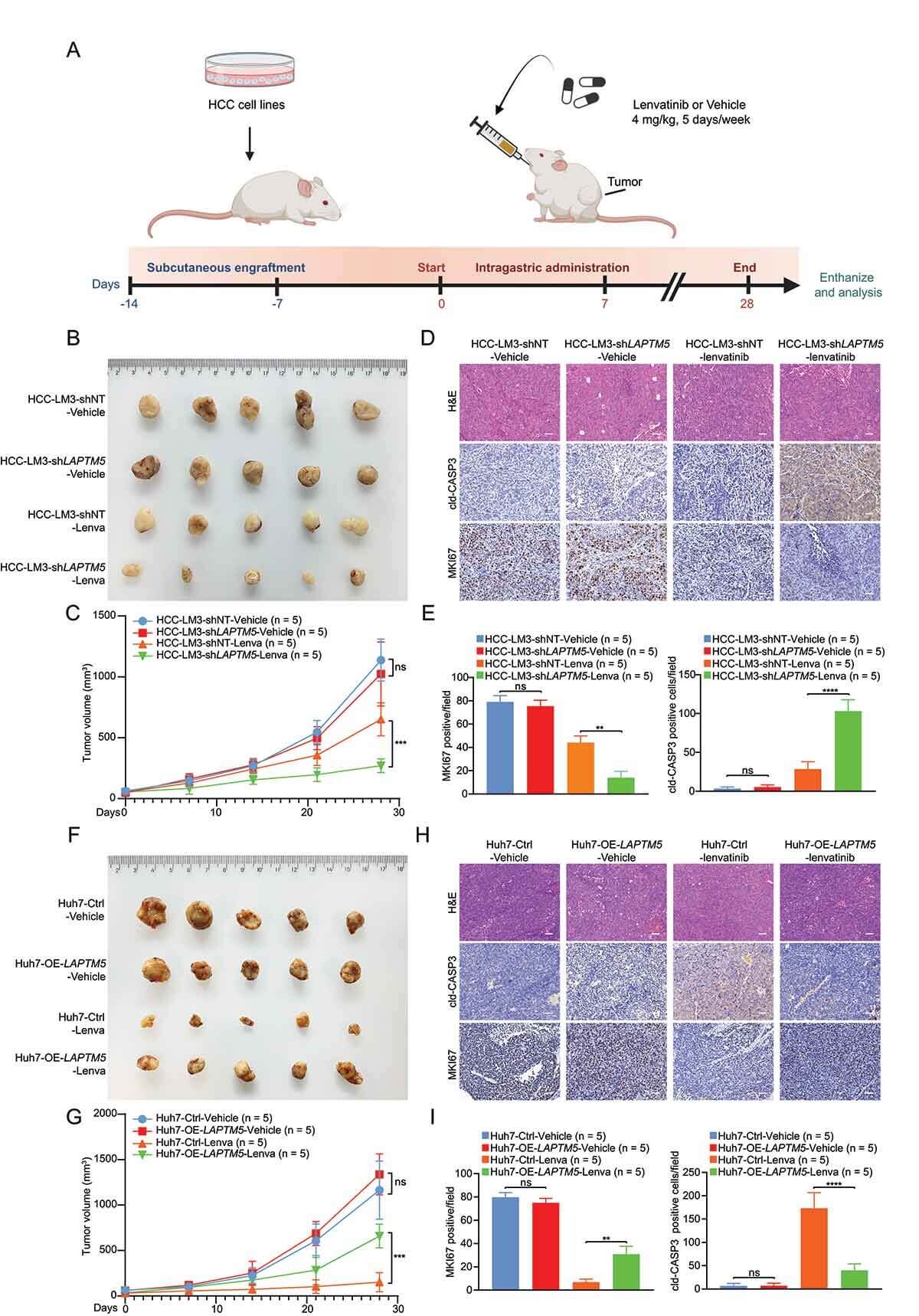
LAPTM5导致HCC体内lenvatinib耐药
为了搞清楚LAPTM5是如何导致耐药的,研究者们进一步研究了它的作用机制,分析发现,LAPTM与自噬过程密切相关。LAPTM5能够抑制溶酶体的功能。溶酶体是自噬过程中的关键细胞器,负责降解受损的细胞器和外源性物质(如药物)。当LAPTM5过多时,溶酶体的功能被抑制,自噬过程受阻,导致乐伐替尼无法被有效降解,从而让癌细胞“逃过一劫”。除了直接抑制溶酶体功能,LAPTM5还通过调控mTOR信号通路影响自噬过程。mTOR是细胞内的“营养感应器”,能够抑制自噬。研究发现,LAPTM5过表达会激活mTOR信号通路,从而抑制自噬,进一步促进癌细胞存活和耐药。
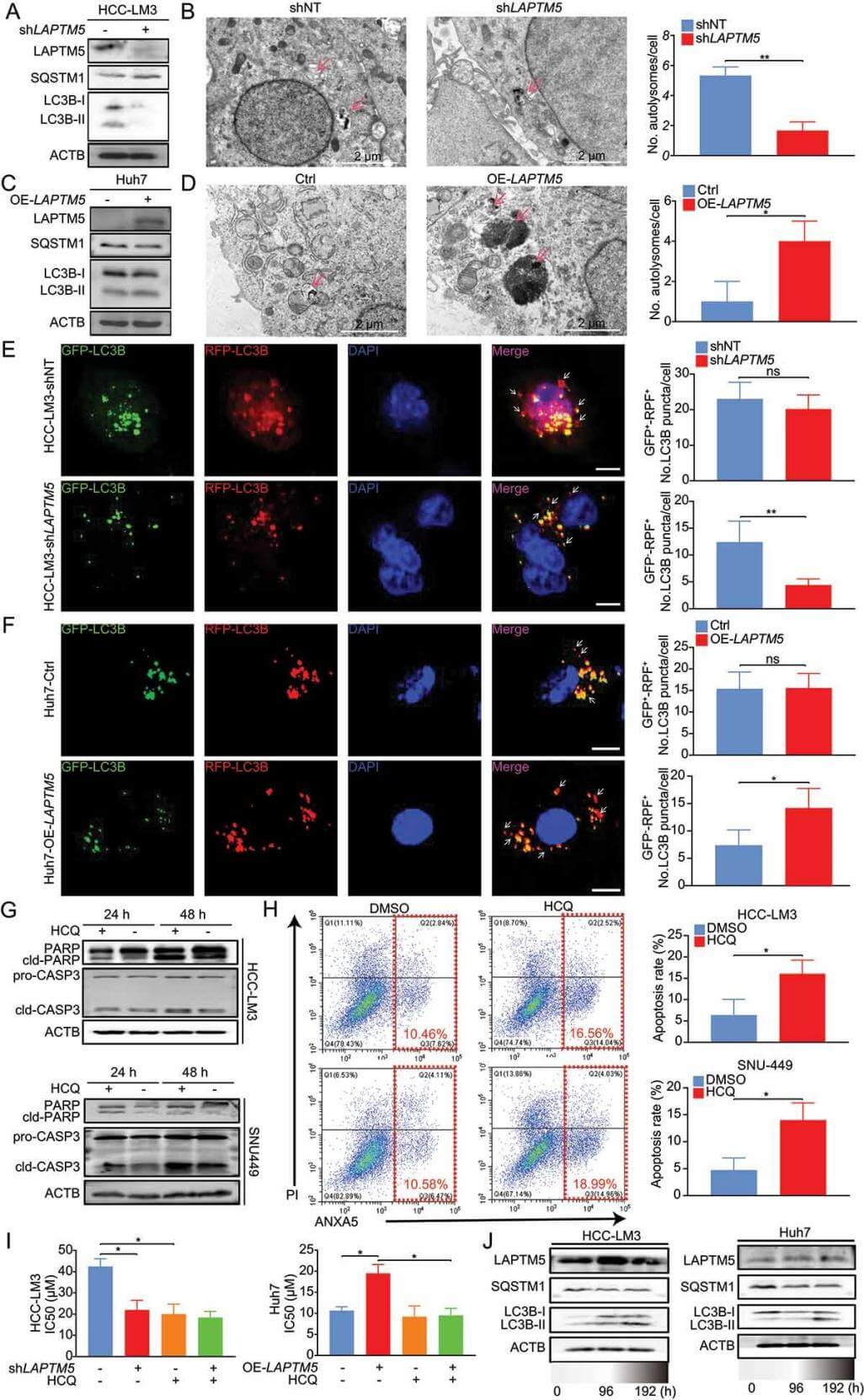
LAPTM5增强自噬通量以降低HCC对lenvatinib的敏感性
考虑到HCC是一种具有不同遗传背景的异质性肿瘤,研究者们又通过PDC和PDO模型研究了LAPTM5对lenvatinib耐药性的影响。结果显示,无论遗传背景如何,LAPTM5都是HCC中lenvatinib耐药的关键因素。
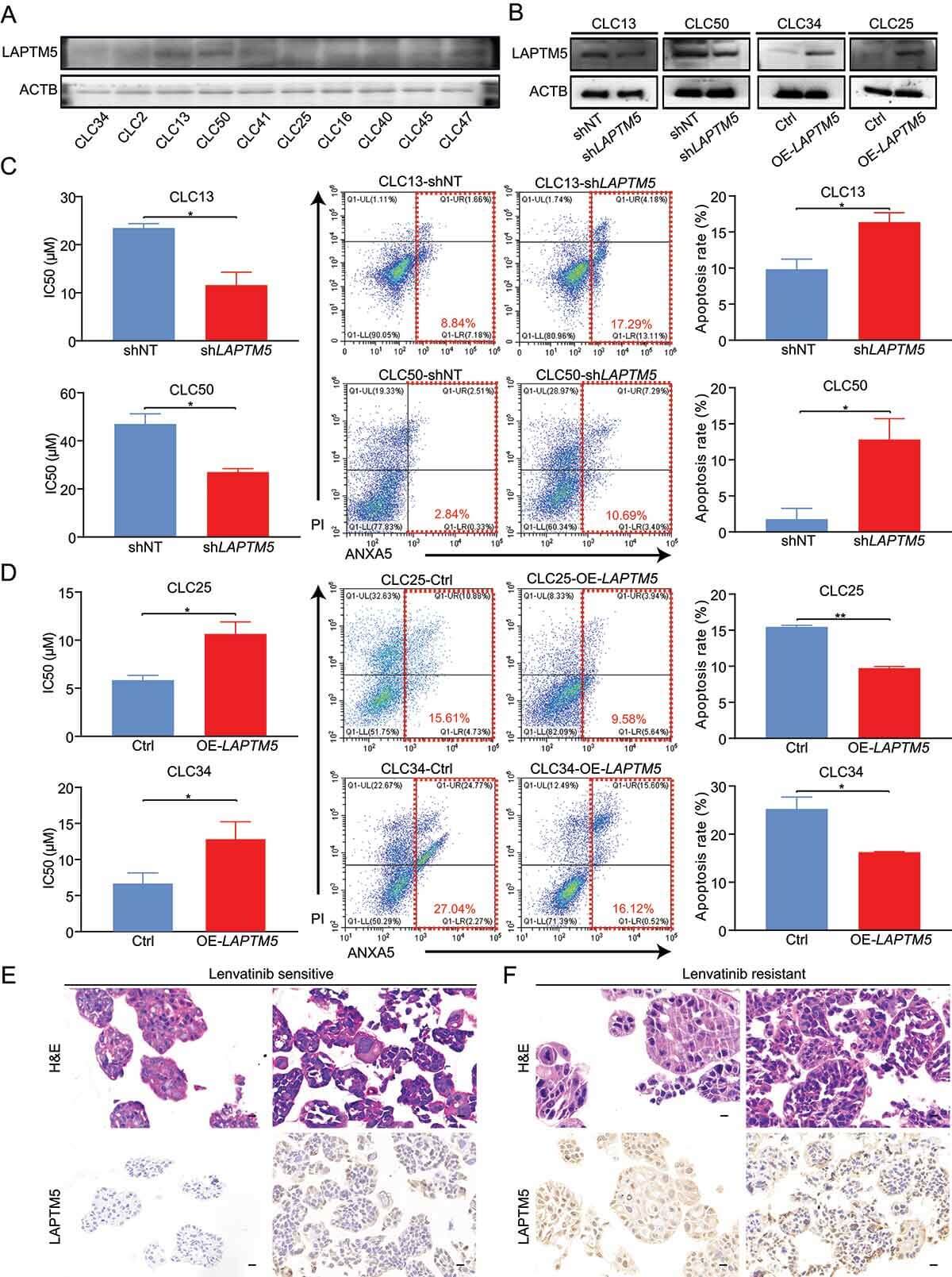
PDC和PDO模型分析了LAPTM5与HCC对lenvatinib敏感性之间的关联
为了进一步验证LAPTM5的临床意义,我们随后通过分析临床样本评估了LAPTM5与lenvatinib耐药性之间的关联。研究者们发现复发患者表达的 LAPTM5 水平显著高于无复发患者 (1.87 倍,P < 0.001),这一观察结果表明,LAPTM5 上调导致lenvatinib耐药,因为lenvatinib治疗后的早期复发也可能被视为耐药性的象征,LAPTM5 或许可作为一种可靠的生物标志物,用于预测患者对lenvatinib的反应,从而为临床干扰提供精确指导。
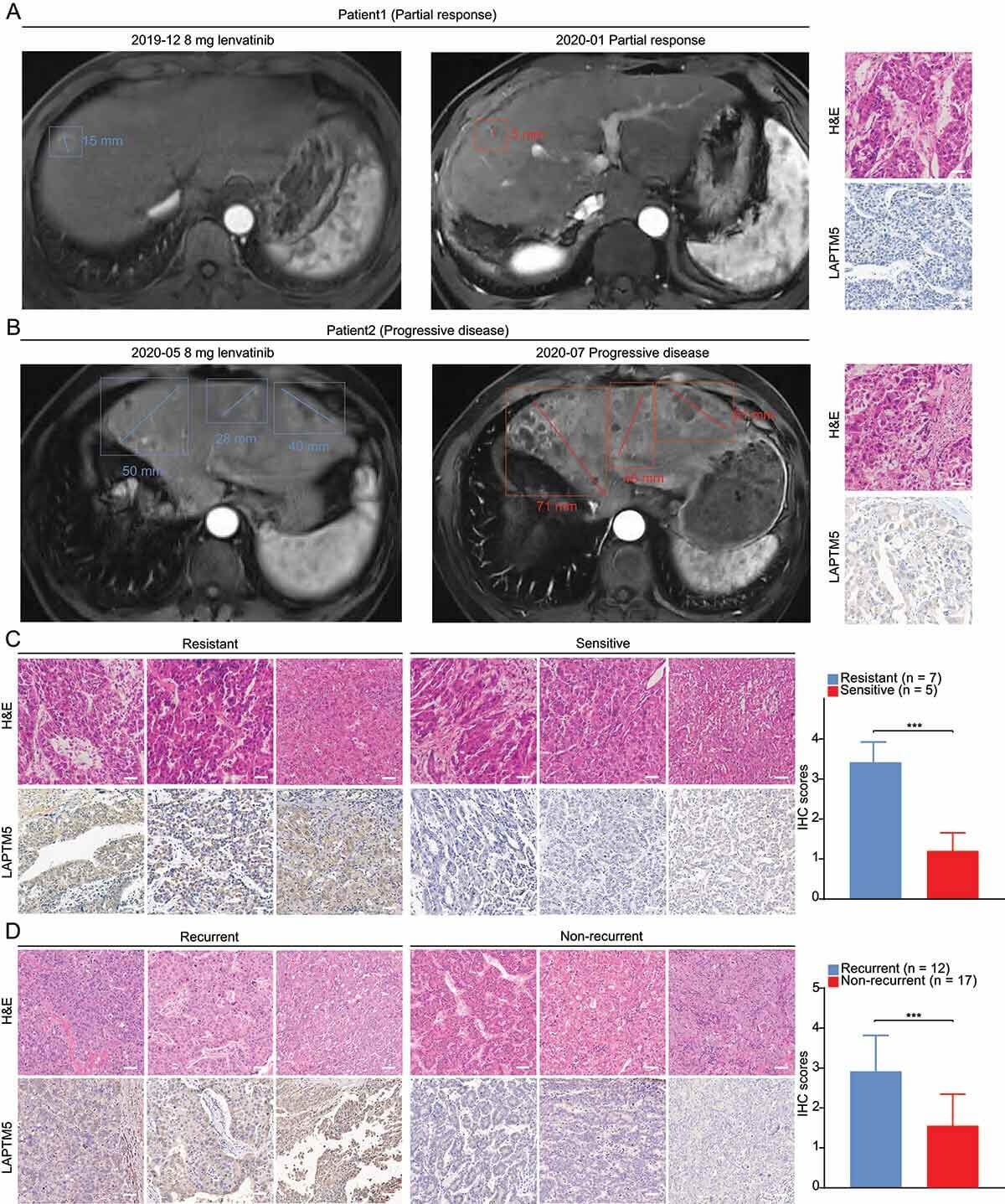
通过临床样本评估LAPTM5与对lenvatinib反应之间的关联
总结
这项研究利用CRISPR文库筛选技术,揭示了LAPTM5在肝癌乐伐替尼耐药中的关键作用。LAPTM5通过抑制自噬过程,帮助癌细胞“逃避”药物攻击。这一发现不仅为我们理解耐药机制提供了新视角,还为未来的肝癌治疗提供了潜在的新策略。
CRISPR文库筛选在自噬研究中的重要意义
- 1. 高通量筛选:CRISPR文库能够快速、高效地筛选出与自噬相关的基因,为研究自噬机制提供了强大工具。
- 2. 精准调控:通过CRISPR技术,科学家可以精确敲除或过表达特定基因,从而深入研究其在自噬中的作用。
- 3. 转化医学价值:CRISPR筛选发现的基因(如LAPTM5)可能成为新的治疗靶点,为癌症治疗带来希望。
对患者的启示
- 1. 耐药问题有望解决:未来,针对LAPTM5的药物可能会成为克服乐伐替尼耐药的新武器。
- 2. 精准医疗的新方向:通过检测LAPTM5的表达水平,医生或许能预测患者对乐伐替尼的治疗反应,实现个性化治疗。
展望
这项研究为肝癌治疗带来了新的希望,但距离临床应用还有一段路要走。未来,科学家们需要进一步验证LAPTM5靶向治疗的安全性和有效性,为肝癌患者带来更多福音。
参考文献:
Genome-Scale CRISPR screen identifies LAPTM5 driving lenvatinib resistance in hepatocellular carcinoma.
源井CRISPR文库产品-Screening-ready Cell Pool
标准升级,超高覆盖度
400+现货快至1周
即买即用,节省10周筛到靶点!
 CRISPR基因编辑技术服务
CRISPR基因编辑技术服务
 红棉 · 基因敲除计划
红棉 · 基因敲除计划

























